2·實(shí)驗(yàn)原理和方法
2.1酸析法原理
堿減量廢水中的對(duì)苯二甲酸鈉與硫酸作用形成對(duì)苯二甲酸。當(dāng)廢液pH值<3時(shí),對(duì)苯二甲酸幾乎不溶于水,因此會(huì)從堿減量廢水中析出。

2.2堿減量廢水水質(zhì)分析
2.2.1 COD的測(cè)定
在強(qiáng)酸性溶液中,一定量的重鉻酸鉀氧化水樣中還原性物質(zhì),過(guò)量的重鉻酸鉀以試亞鐵靈作指示劑、用硫酸亞鐵銨溶液回滴。根據(jù)用量計(jì)算水樣中還原性物質(zhì)的量。
2.2.2稀釋倍數(shù)法色度測(cè)定
將樣品用光學(xué)純水稀釋至用目視比較與光學(xué)純水相比剛好看不見顏色時(shí)的稀釋倍數(shù)作為表達(dá)顏色的強(qiáng)度,單位為倍。
2.2.3濁度測(cè)定
在25℃下,硫酸肼與六次甲基四胺聚合,形成白色高分子聚合物。以不同濃度的聚合物溶液作為濁度標(biāo)準(zhǔn)液,水樣濁度與其相比較而得。
2.2.4對(duì)苯二甲酸含量測(cè)定
對(duì)苯二甲酸溶于氫氧化鈉溶液,讀取分光光度計(jì)A254、A256值,求得(A254-A256)/2。前式的值與對(duì)苯二甲酸濃度在一定范圍內(nèi)成直線關(guān)系,所以可按其測(cè)得的吸光度求出對(duì)苯二甲酸的含量。事實(shí)上,廢水中不含對(duì)苯二甲酸,而是以對(duì)苯二甲酸鈉形式存在。這里所謂的對(duì)苯二甲酸含量是指由對(duì)苯二甲酸鈉換算得到的相應(yīng)值。
2.3對(duì)苯二甲酸特性分析
2.3.1酸值測(cè)定
取1g樣品,加入吡啶10mL,加熱溶解后冷卻至室溫,加入15mL H2O。以酚酞為指示劑,用0.5mol/LKOH標(biāo)準(zhǔn)溶液滴定。
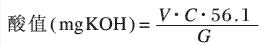
式中,V-KOH標(biāo)準(zhǔn)溶液用量,mL;C-KOH標(biāo)準(zhǔn)溶液濃度,mol/L;G-樣品重量,g。
2.3.2灰分測(cè)定
取2g樣品放入已恒重的20mL坩鍋中,在電爐上小心進(jìn)行碳化。再于馬福爐中在800℃下灼燒至恒重。
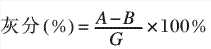
式中,A-樣品灼燒的重量,g;B-坩鍋重量,g;G-樣品重量,g。
2.4絮凝和脫色使用3種不同的有機(jī)高分子絮凝脫色劑(1#,2#,3#)。將稀釋20倍脫色劑加入1L廢水中,攪拌均勻后,靜置20min再進(jìn)行過(guò)濾。
2.5酸析
取絮凝脫色后的堿減量廢水1L,分別緩慢加入濃硫酸并且不斷攪拌,直至pH為2。靜止片刻后,廢水進(jìn)行過(guò)濾。濾液進(jìn)行水質(zhì)分析,而濾餅烘干并測(cè)定對(duì)苯二甲酸特性。
<<上一頁(yè)[1][2][3][4]下一頁(yè)>>

 您所在的位置:
您所在的位置:





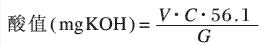









源經(jīng)編.gif)